一,黏土的晶体结构
黏土矿物大体上可分为结晶质与非晶质两类,大部分黏土矿物是晶质矿物,在它们的晶体结构中主要是Si-O四面体与Al-O(OH)八面体复合组成的层状格子,彼此重叠而成。 1,粘土矿物的两种基本构造单元(1)硅氧四面体与硅氧四面体晶片
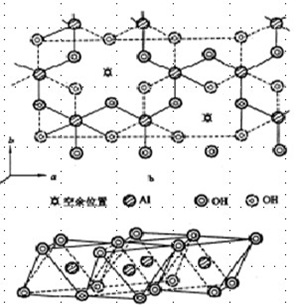
硅氧四面体:有一个硅原子与四个氧原子,硅原子在四面体的中心,氧原子在四面体的顶点,硅原子与各氧原子之间的距离相等,其结构见图。
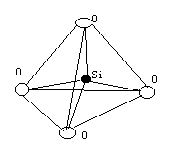
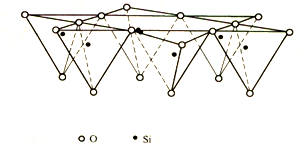
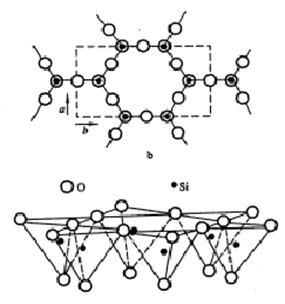
硅氧四面体晶片:指硅氧四面体网络。硅氧四面体网络由硅氧四面体通过相邻的氧原子连接而成,其立体结构见图。由多个硅氧四面体在a、b两方向上有序排列组成四面体片。共有三个层面:两层氧原子和一层硅原子,上下两层氧原子均形成六角环(空心);在a、b两方向上无限延续。
(2)铝氧八面体与铝氧八面体晶片
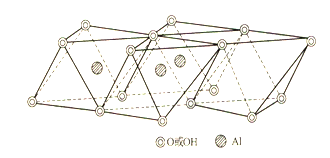
铝氧八面体:由一个铝和六个氧或氢氧原子团组成,铝位于正八面体中心,氧或氢氧原子团位于六个顶角。(如下图所示)。
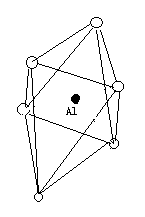
铝氧八面体晶片:多个铝氧八面体通过共用的OH连接而成的Al-O八面体网络。 由多个铝氧八面体在a、b两方向上有序排列组成八面体片,在a、b二维方向上无限延伸。共有三个层面,铝原子层位于中间,上下两个层面组成六角形(实心)。
2,晶片的结合
晶层:由硅氧四面体片与铝氧八面体片组成的在C轴方向上能重复再现的最小单位,通过共用氧原子连接形成电中性的统一结构层,或称基本结构层。
根据基本结构层的不同,层状结构粘土矿物分为:
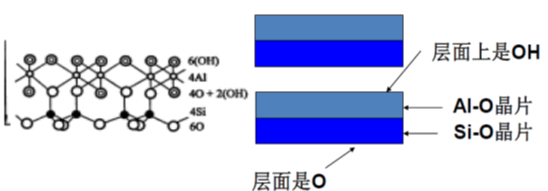
1:1型晶层:由一个硅氧四面体晶片与一个铝氧八面体晶片构成。
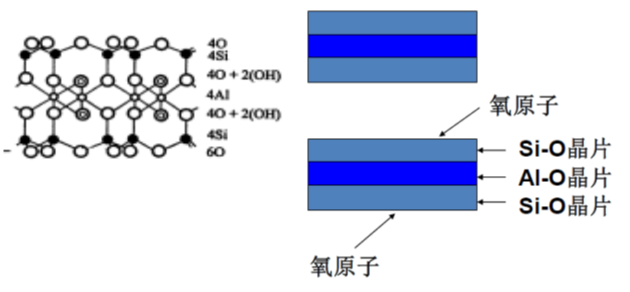
2:1型晶层:由两个硅氧四面体晶片与一个铝氧八面体晶片构成。
3, 晶格取代:占据晶格点阵位置的原子或离子被其它原子或离子取代而晶格点阵保持不变的现象。通常指硅氧四面体中的硅、铝氧八面体中的铝被其它原子(通常为低一价的金属原子)取代,如四面体中的Si4+被Al3+取代,八面体中的Al3+被Mg2+取代。其结果是晶体结构不变,产生过剩电荷,晶体带负电。

二,几种常见黏土的晶体结构
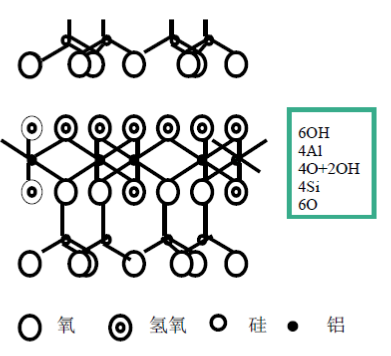
1, 高岭石(Kaolinite)
晶体结构 —— 1:1型
单元晶层由一层四面体片和一层八面体片组成,所有硅氧四面体的尖顶都朝向八面体,通过共用氧原子连接成晶层。若干个晶层在C轴方向上层层重叠,而在a、b轴方向上连续延伸。
特点
· 晶层间连接紧密(晶层一面为“O”层,一面为“OH”层,晶层易形成氢键。)
· 水化分散性差,矿物较稳定,几乎无晶格取代现象。
· C轴间距=7.2埃。
· 阳离子交换容量小,水分子不易进入晶层中间,其水化性能差,造浆性能不好。为非膨胀类型的粘土矿物。
· 晶胞分子式: Al4Si4O10(OH)8
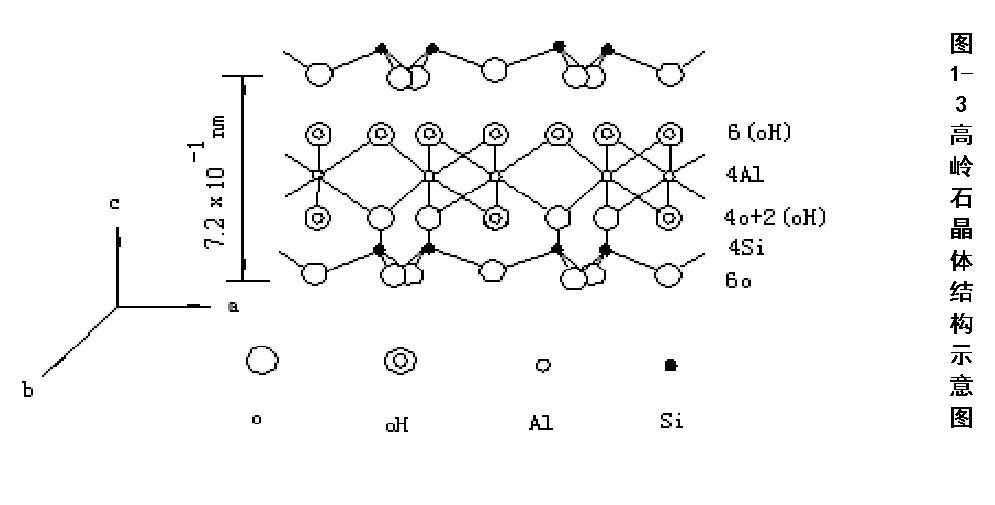
高岭石的片状结构中,一面为OH,另一面为O,晶层之间能形成氢键,故晶层间联接力有氢键力和范德华力,晶层间联接力强,水分子不易进入晶层间;从高岭石的单位晶胞来看,高岭石是电中性,即高岭石很少晶格取代,晶体表面可交换阳离子很少,不易形成扩散双电层,引起层间距增大,因此高岭石是非膨胀性粘土矿物。
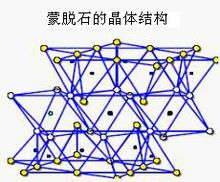
2,蒙脱石
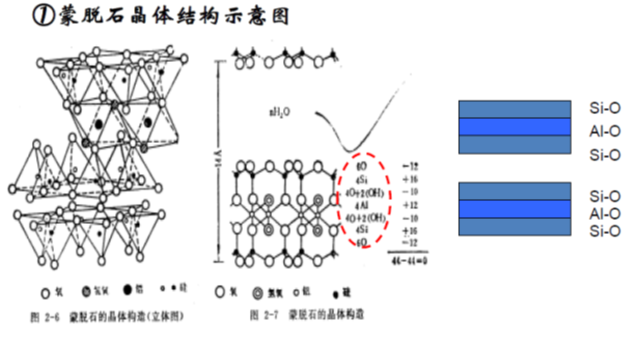
蒙脱石属于2:1型粘土矿物,存在晶格取代,取代位置主要在Al-O八面体中,即Al³⁺被 Mg²⁺、Fe²⁺和Zn²⁺等取代,产生的负电荷由等量的Na⁺或 Ca²⁺来平衡。晶胞分子式:Al₄Si₈O₂₀(OH)₄
两片硅氧四面体片中间夹一片铝氧八面体片。每个四面体顶点的氧均指向中央的八面体,通过共用的氧连接成晶层。若干个晶层按一定距离在C轴方向上重叠构成晶体。
蒙脱石上下相临的层面皆为O面,晶层间引力以分子间力为主,层间引力较弱,水分子易进入晶层。
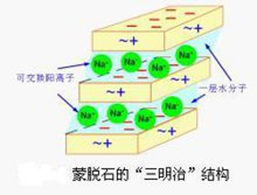
蒙脱石由于晶格取代产生较多的负电荷,在它周围,必然会吸附等电量的阳离子,水化阳离子给粘土带来厚的水化膜,使蒙脱石膨胀。 所以,蒙脱石是膨胀型粘土矿物,其胶体活性较大。
蒙脱石晶胞形成的层状结构存在某些阳离子,如Ca、Mg、Na、K等,且这些阳离子与蒙脱石晶胞的作用很不稳定,易被其它阳离子交换,故具有较好的离子交换性。
膨润土是以蒙脱石为主的矿物,依据蒙脱石层间吸附的阳离子的类型,可以对膨润土进行分类。层间阳离子为Na+时称钠基膨润土;层间阳离子为Ca2+时称钙基膨润土;层间阳离子为H+时称氢基膨润土(活性白土、天然漂白土-酸性白土)。
膨润土的层间阳离子可以置换,将钙离子置换为钠离子的称为(活化的)钠基膨润土,将层间阳离子置换为锂离子时称为锂基膨润土,将层间阳离子置换为有机阳离子时称为有机膨润土。
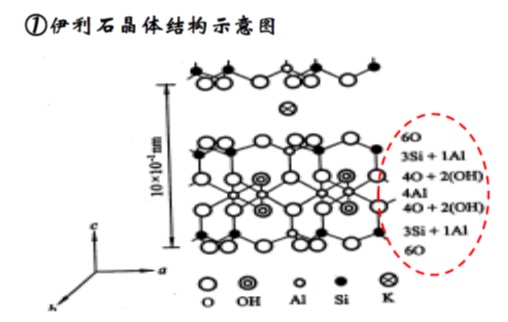
3,伊利石
伊利石是一种层状硅酸盐云母类粘土矿物,含有结构水和多量的吸附水,化学式为
K₁Al₂[(Al,Si)Si₃O₁₀(OH)₂•nH₂O]
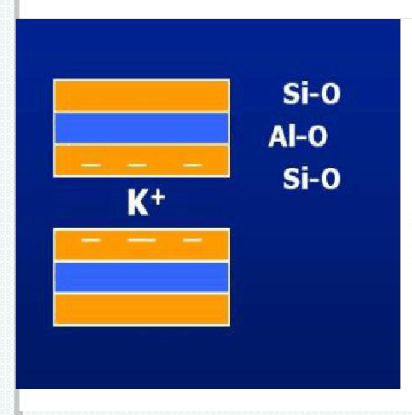
伊利石属于2:1型粘土矿物,存在晶格取代,取代位置主要在Si-O四面体中,且取代数目比蒙脱石多,产生的负电荷由等量的K⁺来平衡,晶层间引力以静电力为主,引力强,晶层间距C=10Å,属非膨胀型粘土矿物。
伊利石由于晶格取代作用产生的负电荷由K⁺来平衡,由于伊利石取代位置主要在Si-O四面体中,产生的负电荷离晶层表面近,故与K⁺产生很强的静电力, K⁺不易交换下来。
K⁺的大小刚好嵌入相邻晶层间的氧原子网格形成的空穴中,起到连接作用,周围有12个氧与它配伍,因此, K⁺连接通常非常牢固,不易交换下来。
伊利石也称为水云母,其晶体构造和蒙脱石类似,主要区别在于晶格取代作用多发生在四面体中,铝原子取代四面体的硅。晶格取代作用也可以发生在八面体中,典型的是Mg²⁺和Fe²⁺取代Al³⁺,其晶胞平均负电荷比蒙脱石高,产生的负电荷主要由K⁺来平衡。
伊利石负电荷主要产生在四面体晶片,离晶层表面近,K⁺与晶层的负电荷之间的静电引力比氢键强,水也不易进入晶层间;
另外,K⁺的大小刚好嵌入相邻晶层间的氧原子网格形成的空穴中,起到连接作用,周围有12个氧与它配位;因此,K⁺连接通常非常牢固,是不能交换的。仅粘土颗粒外表面能发生离子交换,其水化作用仅限于外表面。水化膨胀时,其体积增加的程度比蒙脱石小得多。因此,伊利石晶格不易膨胀。
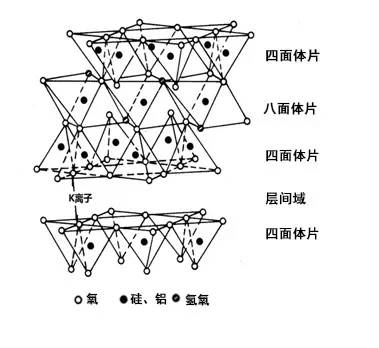
4,海泡石与凹凸棒土
海泡石与凹凸棒土同属海泡石族,晶体构造多为纤维状,属层链状结构的含水富镁硅酸盐矿物。在链状结构中也含有层状结构类型的小单元,属2∶1型。
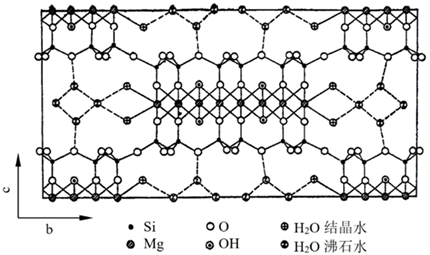
凹凸棒石的化学分子式为Mg₅(H₂O)₄[Si₄O₁₀]₂(OH)₂·4H₂O,其理想结构模型如图1,海泡石的化学分子式为Mg₈(H₂O)₄(Si₆O₁₅)₂(OH)₄·8H₂O,其理想结构模型如下图。
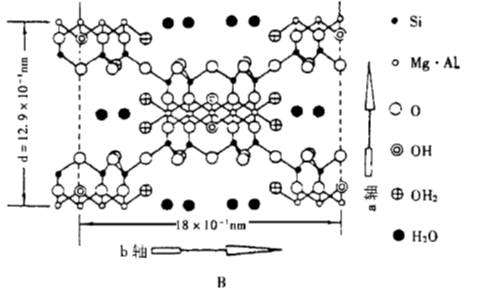
其共同特点是:硅氧四面体所组成的六角环都依上下相反方向对列,并且相互间被其它的八面体氧或氢氧群所连接,铝或镁位居八面体的中央,同时,构造中还保留了一系列的晶道,具有极大的内部表面,水分子可以进入内部孔道。水以三种形态存在于其中,一种是结构水OH,另一种是进入晶体通道的水分子H2O,还有一种是与晶体通道壁镁离子配位的结合水OH2。
海泡石和凹凸棒土晶体中的单元层孔洞可容纳更多的水分子(即沸石水)。同时,又因它的三维立体键结构和Si-O-Si键把细链拉在一起,使其具沿一向延长的特殊晶形,故颗粒呈棒状。结构中所构成的开式沟枢与晶体长轴平行,这种沟槽对极性分子的吸附性能极强。这种特殊结构决定了它拥有包括贯穿整个结构的沸石水通道和孔洞以及大的表面积,在通道和孔洞中可以吸附大量的水或极性物质,包括低极性物质,因此具有很强的吸附能力。
海泡石与凹凸棒土之间的差别在于海泡石中镁硅离子的数目比凹凸棒石多,结晶水和沸石水的数量比凹凸棒石多。它们所不同的是这种单元层与单元层之间的孔道不同。在结构上海泡石晶体中Mg-O八面体的宽度比凹凸棒石宽。海泡石的单元层孔洞可加宽到3.8×9.8Å[8],最大者可以5.6×11.0Å[6],即可容纳更多的水分子(即沸石水)。因而使海泡石具有比凹凸棒石有更加优越的物理、化学性能和工艺特性。
5、累托石
累托石是二八面体云母和二八面体蒙脱石1:1规则间层粘土矿物,晶体化学通式为:Kₓ(H₂O){Al₂[AlₓSi₄₋ₓO₁₀](OH)₂}。晶体结构式可分为云母层和蒙脱石层二部分。累托石晶体中含有蒙脱石层,因此具有蒙脱石的膨胀性质和阳离子交换性质。同时也含有云母层,因此具有优于蒙脱石的热稳定性。
无机(黏土类)悬浮剂
黏土类悬浮剂的性能和在涂料上的应用
有机高分子悬浮剂的性能和在涂料中的应用
版权所有 © 2025 www.foundrycoating.com 转载请注明来源并附上原文链接
请勿摘录或复制本网站内容并发布至其他网站或嵌入他人文章中,而不注明来源或署名。